即日起,分析测试中心将不定期推送冷冻电镜国内外应用案例,供各团队谋划使用冷冻电镜设备开展科研创新提供参考!
题目:Cryo-EM structure of the RADAR supramolecular anti-phage defense complex
链接: DOI: 10.1016/j.cell.2023.01.012

细菌编码多样化的抗噬菌体免疫系统库,来对抗噬菌体感染。CRISPR-Cas是主要的占疫库的主要部分,但其他防御系统稀疏地分布在微生物基因组中。在过去几年中,已发现了 60 多个抗噬菌体防御系统,尽管其中少数的作用机制已被确定,大多数仍是未知。2023年2月9日,哈佛医学院Philip J. Kranzusch及以色列魏茨曼科学研究所Rotem Sorek共同通讯在Cell 在线发表题为”Cryo-EM structure of the RADAR supramolecular anti-phage defense complex“的研究论文。该研究确定了RADAR防御复合物的冷冻电镜结构,揭示RdrA是一个七聚体,两层AAA+ ATP酶,RdrB是一个十二聚体,空心复合物,有12个表面暴露的脱氨酶活性位点。RdrA和RdrB连接形成一个高达10个MDa的大型组件,RdrA作为一个漏斗停靠在RdrB活动站点之上。研究结果表明,RdrB在体外催化ATP转ITP的转换,并在体内噬菌体感染过程中诱导肌苷单核苷酸的大量积累,限制噬菌体复制;ATP单核苷酸脱氨是RADAR免疫的决定因素,并揭示了核苷酸修饰机的超分子组装是抗噬菌体防御机制。
RdrA的冷冻电磁结构显示出一个七聚体组装体,具有两层相互锁扣的蛋白质结构域。RdrA组装的顶层包含七个N端AAA+ ATP酶结构域,每个邻近亚基之间形成一个活性位点。RdrA C端从N端AAA+结构域延伸,是一个主要为α螺旋状的叶瓣,环绕组装体形成七聚体复合物的外扩底层。
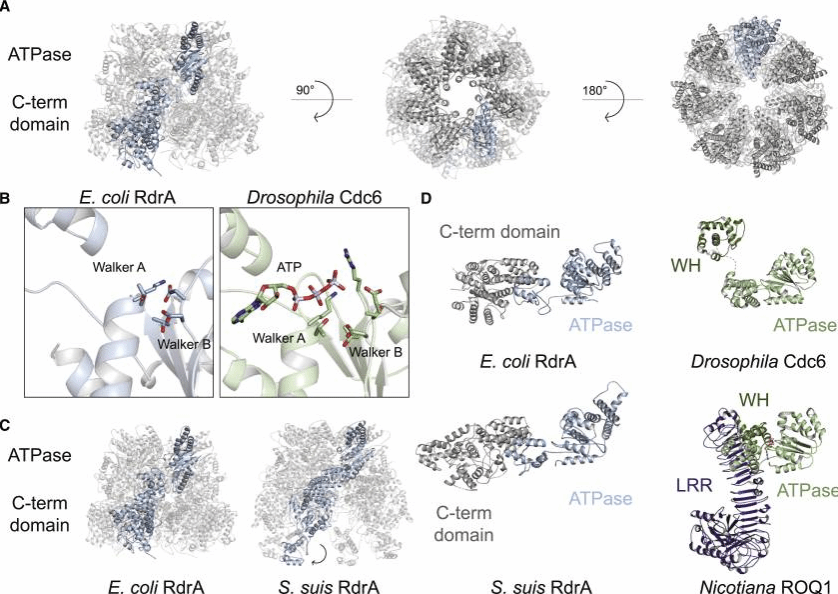
图1.RdrA的结构显示出一个具有独特C端结构域的两层七聚体ATP酶组装
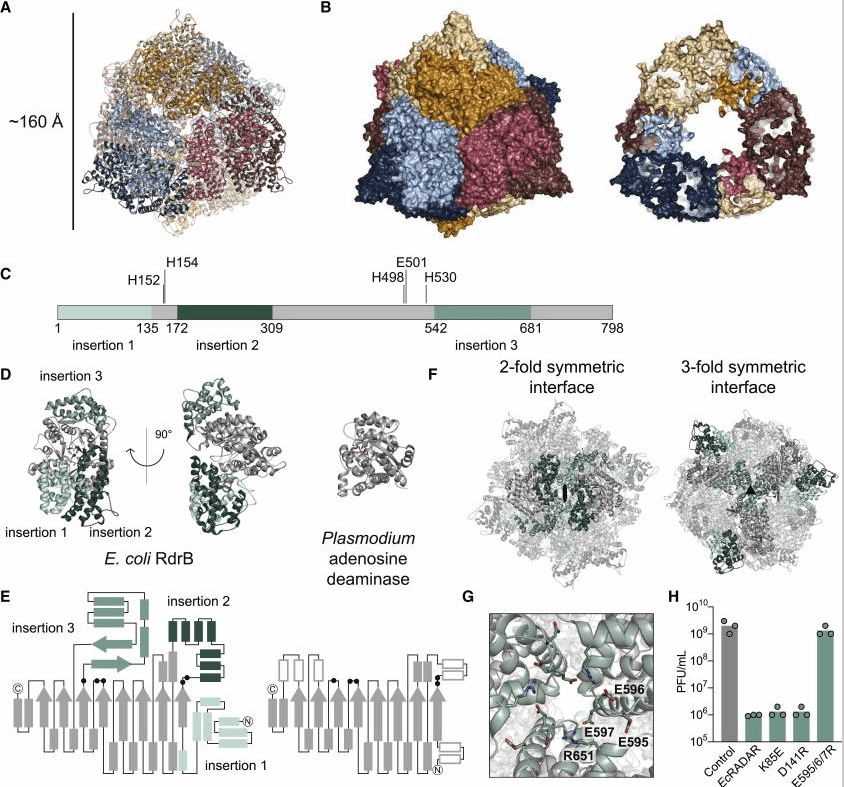
冷冻电镜技术构建的图像可知,RdrB由12个亚基组装成直径160Å的空心环,表面暴露12个脱氨酶活性位点。切面图显示其内部空腔可容纳核苷酸底物,而三个独特插入序列(Insertion 1-3)介导了十二聚体的对称组装。破坏Insertion 3中的谷氨酸位点(如E595R)会导致十二聚体解聚,完全丧失抗噬菌体功能。图3D展示了活性位点的单核苷酸靶向特征。RdrB的活性位点包含组氨酸四联体(H152/H154/H498/H530)和催化谷氨酸(E501),与疟原虫腺苷脱氨酶(ADA)的结构高度同源,但与RNA编辑酶(如ADAR)无相似性。这直接证明RdrB的天然底物为单核苷酸而非RNA。
与大多数形成六聚体组装的闭环AAA+蛋白不同,RdrA是一个非典型复合体,拥有7个重复亚基。RdrA还缺少许多AAA+蛋白类群中常见的前传感器1β发夹插入,18,21,而是包含两个与指定AAA+类群无关的大插入点。第一次RdrA插入发生在β2和β3链之后,其中标准单螺旋α2被一个四螺旋束取代,形成七聚体复合体顶部的冠状结构。
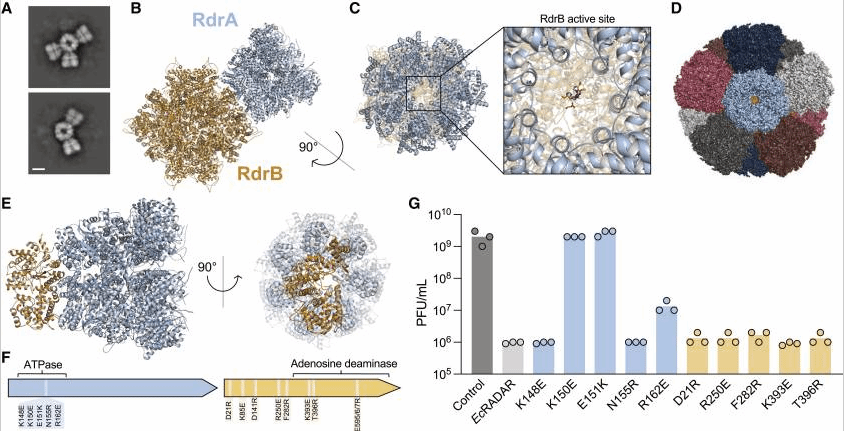
图3. RdrA和RdrB形成抗噬菌体防御所需的超分子复合物
研究团队利用冷电电镜定义了雷达复合体组装的机制,并证明七聚体RdrA亚基在核心十二聚体RdrB壳体上对接,形成一个巨大的花形防御复合体。RdrA亚基在RdrB活性位点形成漏斗,表明RdrB催化中心在结构上与作用于单核苷酸底物如AMP的腺苷脱氨酶同源。噬菌体感染后,RADAR诱导ITP和dITP的快速积累。纯化的RdrB催化ATP转化为ITP,dATP转化为dITP,确认RADAR直接靶向单核苷酸底物的能力。否定了“RNA编辑防御”的传统假设,提出“单核苷酸脱氨中毒”新机制,ITP/dITP的积累可特异性抑制噬菌体核酸合成。进化启示,超分子组装策略与哺乳动物炎症小体等免疫复合物高度相似,暗示其可能是生物防御中的保守机制。
本文来源 [结构系统生物学]
推文原链接:https://mp.weixin.qq.com/s/rvd_7LEoYhD4pgpEOb5AMQ?scene=1&click_id=1
福建农林大学分析测试中心
2025年12月3日